Untersuchung der Sicherheit und Wirksamkeit eines Stentgraft-Systems zur endovaskulären Aortenreparatur (EVAR) mit Angulationskontrolle für Patienten, die bislang als unbehandelbar betrachtet wurden
W. L. Gore Associates, Inc. (Gore) gab heute die erste Implantation der GOREEXCLUDER Conformable AAA-Endoprosthese in den Vereinigten Staaten bekannt. Der erfolgreiche Eingriff wurde am 19. Dezember 2017 im Maimonides Medical Center in New York von Robert Rhee, MD, Leiter der endovaskulären Gefäßchirurgie und nationaler Hauptprüfer, durchgeführt.
Diese Pressemitteilung enthält multimediale Inhalte. Die vollständige Mitteilung hier ansehen: http://www.businesswire.com/news/home/20180103006086/de/
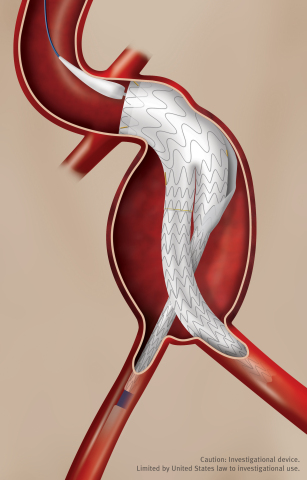
GORE EXCLUDER Conformable AAA Endoprosthesis (Photo: Business Wire)
Dieses EVAR-Implantat, das erste mit Angulationskontrolle, ist Teil einer von der U.S.-amerikanischen Arzneimittelbehörde Food and Drug Administration (FDA) genehmigten klinischen Studie. Diese Studie wird die Sicherheit und Wirksamkeit des Implantats zur Behandlung von infrarenalen Aortenaneurysmen (AAA) in Patienten mit schwierigen anatomischen Verhältnissen untersuchen. Die klinische Studie besteht aus zwei Unterstudien, die das Implantat jeweils für ein anderes Spektrum von anatomischen Verhältnissen beurteilen. Die Implantation durch Dr. Rhee ist Teil der Kurzhals-Teilstudie zur Bewertung des Implantats in Aortenhalswinkeln von 0 bis 60 Grad und Aortenhalslängen von 10 mm oder länger. Die Teilstudie zur hohen Halswinkelung bewertet Aortenhalswinkel von 61 bis 90 Grad und Aortenhalslängen von 10 mm oder länger.
"Patienten mit komplexen anatomischen Strukturen im proximalen Halsbereich kommen oft für EVAR nicht in Frage. Ungeachtet der Flexibilität des Implantats machen aktuelle Einführsysteme eine Anpassung bei der Platzierung schwierig?, sagte Dr. Rhee. "Die Angulationskontrolle des neuen Implantierungssystems für die GORE EXCLUDER Conformable AAA-Endoprothese erlaubt Ärzten eine größere Kontrolle über die Ausrichtung und Winkelung des Implantats zur Erzielung einer orthogonalen Platzierung im Lumen des Blutflusses der Hauptschlagader.?
Die GORE EXCLUDER Conformable AAA-Endoprothese baut auf der erwiesenen klinischen Leistungsfähigkeit des EXCLUDER Implantats auf, das auf einer 20jährigen Erfahrung weltweit und mehr als 300.000 behandelten Patienten* beruht, eine Erfolgsgeschichte, bei der derzeit verfügbare AAA-Stentgrafts nicht mithalten können. Das neue Implantat nutzt das Schenkel-Design des GORE EXCLUDER-Implantats, das mit einer Astverschlussrate von 0,5 während der dreijährigen Nachbeobachtungszeit eine außerordentliche klinische Leistungsfähigkeit unter Beweis gestellt hat.** Die Schenkel, eine einzigartige Kombination von proprietärem ePTFE-Graftmaterial und einem umfassend unterstützten, verschachtelten Nitinol-Stent, sind darauf ausgelegt, sowohl eine Knickung als auch einen Verschluss zu verhindern.
Die GORE EXCLUDER Conformable AAA-Endoprothese bringt das GORE ACTIVE CONTROL-System erstmalig in die abdominelle Aorta. Dieses Versorgungssystem umfasst eine Angulationskontrolle, die den Ärzten die Option eröffnet, die Endoprothese so auszusrichten und zu winkeln, dass eine orthogonale Platzierung im Lumen des Blutflusses der Hauptschlagader erzielt und die Anpassbarkeit und die Abdichtung der Endoprothese maximiert wird. Wie das GORE C3 Versorgungssystem bietet das GORE ACTIVE CONTROL-System nach der anfänglichen Platzierung erforderlichenfalls die Möglichkeit einer Repositionierung der Endoprothese zur Erzielung einer optimalen Platzierung.
"Dieses Implant ist der letzte Schritt in unseren kontinuierlichen Bemühungen, die umfassendsten und modernsten endovaskulären Behandlungsmöglichkeiten auf dem Markt anzubieten?, sagte Eric Zacharias, Vascular Business Leader. "Seit der Markteinführung unseres ersten EVAR-Implantats von zwei Jahrzehnten hat es sich Gore zum Ziel gemacht, innovative Lösungen zu entwickeln, die die endovaskuläre Behandlung von Aortenerkrankungen erweitern. Aus der Zusammenarbeit mit unseren ärztlichen Partnern haben wir erfahren, dass es in hochabgewinkelten anatomischen Verhältnissen mit den derzeit verfügbaren EVAR-Implantaten schwierig ist, eine optimale Abdichtung zu erzielen. Die IDE-Studie wird untersuchen, ob das System in der Lage ist, den ungedeckten Bedarf nach einem EVAR-Implantat zur Behandlung solcher Patientengruppen zu decken. Das System vereint das verschachtelte Stentdesign, das sich in der Conformable GORE TAG Thorax-Endoprosthese bewährt hat, mit der Repositionierbarkeit des GORE C3-Versorgungssystems, wobei das neue Leitungsmerkmal der Angulationskontrolle den Bedarf nach einem EVAR-Implantat abdeckt, dass auch in schwierigeren anatomischen Verhältnissen eingesetzt werden kann.?
Die GORE EXCLUDER Conformable AAA-Endoprosthese gehört zu einer wachsenden Familie von endovaskulären Produkten, deren Ziel die wirksame Behandlung von Aortenerkrankungen ist und von Gores hochgeschätzten klinischen Unterstützungssystem und Bildungsangebot unterstützt wird. Das breit gefächerte Produktportfolio beinhaltet die Conformable GORE TAG Thorax-Endoprosthese zur Behandlung von thorakalen Aortenaneurysmen, Durchtrennungen und Type-B-Transsektionen; die GORE EXCLUDER Iliakalast-Endoprothese (Iliac Branch Endoprosthesis, IBE), die erste von der FDA zugelassene Standardendoprothese, die endovaskuläre Behandlung von häufigen Beckenarterienaneurysmen oder aortoiliakalen Aneurysmen indiziert ist; die GORE VIABAHN Endoprosthese, der führende Stentgraft zur Behandlung von komplexen peripheren Gefäßerkrankungen sowie die ballonexpandierbare Endoprothese GORE VIABAHN VBX, der erste von der FDA zugelassene ballonexpandierbare Stentgraft zur Behandlung von in iliakalen Arterien auftretenden de novo-Läsionen oder wiederverengten Läsionen, einschließlich Läsionen an der Aortenbifurkation.
Im Hinblick auf weitere Hinzufügungen zum Portfolio von gebranchten Gore-Produkten laufen derzeit Studien zur GOREEXCLUDER Thoracoabdominal Branch Endoprosthesis (TAMBE) und es werden auch weiterhin Patienten in die Zulassungsstudie für GORE TAG Thoracic Branch Endoprosthesis (TBE) aufgenommen, in der die Sicherheit und Wirksamkeit zur Behandlung von Läsionen am Aortenbogen und der deszendierenden thorakalen Aorta unter Aufrechterhaltung des Flusses in einem einzigen Blutgefäßast des Aortabogens bewertet wird. Es handelt sich bei beiden Implantaten um Prüfprodukte, die noch nicht zum kommerziellen Vertrieb zugelassen sind.
Basierend auf der Anzahl der verteilten Rumpf-ipsilateralen Schenkel.
** GREAT. n 3,273. Zur Berechnung der Gesamtereignisraten vom Eingriff bis zum Ende des Studienzeitraums werden alle Probanden eingeschlossen, die ein solches Ereignis hätten erleben können, ungeachtet der Länge der Nachbeobachtung. Hinsichtlich der Ergebnisdaten erfasst GREAT lediglich die vom Standort gemeldeten schwerwiegenden unerwünschten Ereignisse.
Umfassende Informationen über Indikationen und andere wichtige Sicherheitsinformationen für hierin erwähnte kommerzielle Gore-Produkte sind der jeweiligen Gebrauchsanweisung (Instructions for Use, IFU) zu entnehmen.
MEDICAL PRODUCTS DIVISION
Die Gore Medical Products Division entwickelt Produkte zur Behandlung von kardiovaskulären Erkrankungen und anderen gesundheitlichen Problemen. Mit mehr als 40 Millionen Medizinprodukten, die im Laufe von mehr als 40 Jahren implantiert wurden, baut Gore auf seinem Vermächtnis auf, die Patientenresultate durch Forschungs-, Bildungs- und Qualitätsinitiativen zu verbessern. Produktleistung, Benutzerfreundlichkeit und Servicequalität resultieren in nachhaltigen Kosteneinsparungen für Ärzte, Krankenhäuser und Versicherungsträger. Gore arbeitet eng mit Medizinern zusammen und dank dieser Zusammenarbeit können wir die Lebensqualität verbessern. www.goremedical.com
Über W. L. GORE ASSOCIATES
Als globales Unternehmen im Bereich der Werkstoffwissenschaften engagiert sich W. L. Gore Associates für die Transformation von Industrien und Verbesserung der Lebensqualität. Seit seiner Gründung im Jahr 1958 hat sich Gore einen Namen als Partner für die Lösung komplexer technischer Herausforderungen unter den anspruchsvollsten Bedingungen erarbeitet: von der Revolutionierung der Oberbekleidungsindustrie durch das GORE-TEX -Gewebe über die Entwicklung von Medizinprodukten, die Leben retten und die Lebensqualität verbessern, bis hin zur Ermöglichung neuer Höchstleistungen beispielsweise in der Luftfahrt, der Pharmaindustrie und dem Markt für mobile Elektronik. Das Unternehmen ist außerdem für seine starke, teamorientierte Kultur und kontinuierliche Anerkennung durch das Institut "Great Place to Work ". Das Unternehmen mit Sitz in Newark, Delaware, beschäftigt rund 9.500 Mitarbeiter ("Associates") und erwirtschaftet Jahreseinnahmen von über 3 Mrd. USD. www.gore.com
Aufgeführte Produkte sind möglicherweise nicht an allen Märkten erhältlich.
GORE, GORE-TEX, ACTIVE CONTROL, C3, EXCLUDER, TAG, VBX und VIABAHN sind Marken von W. L. Gore Associates.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.
Originalversion auf businesswire.com ansehen: http://www.businesswire.com/news/home/20180103006086/de/
Contacts:
Medien:
Bliss Integrated Communication für Gore Medical
Claire LaCagnina, 212-840-8079
Claire@blissintegrated.com
oder
Liz DeForest, 212-584-5477
Liz@blissintegrated.com
