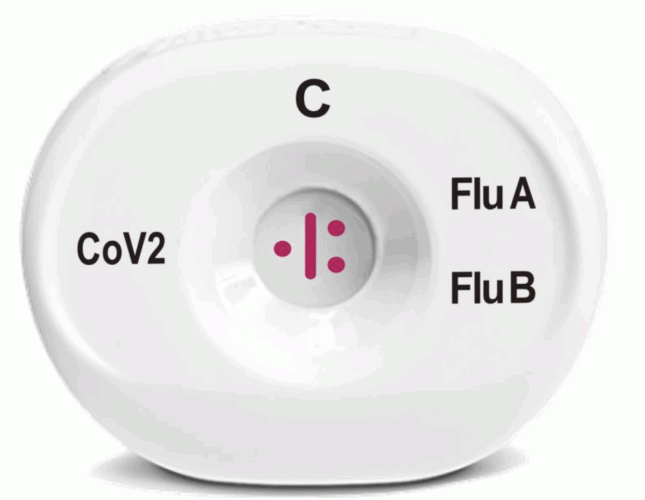
Dieser Drei-in-Eins-Test basiert auf Medmiras firmeneigener Technologie und wurde entwickelt, um zwischen SARS-CoV-2 und Influenza A- oder B-Infektionen zu unterscheiden.

Endlich! Darauf haben wir nun wirklich lange warten müssen. Aber das ist der absolute Hammer. Ein Test der zwischen Corona und Grippeviren unterscheiden kann.
Hier die Deutsche Übersetzung der Meldung:
MEDMIRA KÜNDIGT VYRA COV2FLU UND WEITERE ZULASSUNGSMÖGLICHKEITEN AN
Medmira Inc. hat seine VYRA-Produktlinie durch die Einführung des VYRA CoV2Flu-Schnelltests erweitert. Dieser Drei-in-Eins-Test basiert auf Medmiras firmeneigener Technologie und wurde entwickelt, um zwischen SARS-CoV-2 und Influenza A- oder B-Infektionen zu unterscheiden. Darüber hinaus nutzt das Unternehmen die jüngsten regulatorischen Entwicklungen im Zusammenhang mit den de novo/510(k)-Zulassungsverfahren der US-amerikanischen Food and Drug Administration, indem es seine COVID-19-Produkte beantragt.
Der VYRA CoV2Flu-Test weist gleichzeitig die Nukleokapsid-Antigene von SARS-CoV-2, Influenza A und B nach. In wenigen Minuten können drei unterschiedliche Ergebnisse erzielt werden. Der Test hat bewiesen, dass er die Influenza-A- und -B-Viren aus einem Testpanel nachweisen kann, das die Influenza A (Brisbane/59/07, Brisbane/10/07, Perth/16/2009, Solomon Islands/03/2006, New Caledonia/20/99, Swine NY/01/2009 und Swine Canada/6294/09) und die Influenza B (Lee/40, Florida/02/2006, Brisbane/33/2008 und Panama/45/90) umfasst. Diese positiven Proben wurden alle durch von der Food and Drug Administration zugelassene Influenza-Schnelltests bestätigt.
"Wir sind davon überzeugt, dass unser VYRA CoV2Flu-Produkt den Bedürfnissen der Kunden nach einer Unterscheidung zwischen COVID-19 und Influenza gerecht wird. Mit der einzigartigen RVF-Technologie von Medmira sind wir in der Lage, drei Ergebnisse mit nur einer Probe und in weniger als drei Minuten zu erzielen. Medmira beantragt die CE-Kennzeichnung für VYRA CoV2Flu gleichzeitig mit unserer [Emergency Use Authorisation] und de novo/510(k) Route in den Vereinigten Staaten. Wir gehen davon aus, dass das Produkt Anfang 2022 zunächst in Europa zusammen mit unserer RevealCOVID-19-Produktlinie auf den Markt kommt und anschließend VYRA CoV2Flu in den [Vereinigten Staaten] eingeführt wird", sagte Hermes Chan, Chief Executive Officer von Medmira. "Darüber hinaus freuen wir uns, dass die FDA angekündigt hat, die endgültige Entscheidung über die de novo/510(k)-Zulassung Anfang Januar 2022 zu veröffentlichen, um den FDA-Prüfern, der Medizinprodukteindustrie, den Interessengruppen und der Öffentlichkeit Klarheit und Transparenz über die Erwartungen und Prozesse der FDA für die de novo-Klassifizierung zu bieten. Dies wird es Medmira ermöglichen, einen klaren Weg in Bezug auf den Zeitplan und die Produkteinführung einzuschlagen. Das EUA-Verfahren ist zwar ein laufender und wichtiger Schritt nach vorn, aber wir glauben, dass ein offiziell von der FDA zugelassenes Produkt von den derzeitigen und künftigen Kunden bevorzugt würde."
Die FDA hat eine endgültige Regelung für das de novo/510(k)-Klassifizierungsverfahren erlassen, ein schneller und effizienter Weg für Hersteller neuartiger Medizinprodukte, die eine Zulassung als Produkt der Klasse I oder II beantragen. Zu den Vorteilen des De-novo-Klassifizierungsantrags für neue Produkte gehören kürzere Prüfzeiten und eine feste Klassifizierungsentscheidung, die für mehr Sicherheit während der Lebensdauer des Produkts sorgt. Diese Vorteile stimmen mit Medmiras langfristiger Vision für seine kommenden SARS-CoV-2-Diagnostika überein, und das Unternehmen ist darauf vorbereitet, einen De-novo-Klassifizierungsantrag für seine RevealCOVID-19- und VYRA-Produkte zu stellen, wenn die Regelung im Januar 2022 in Kraft tritt. Medmiras jüngste Zertifizierung für das Medical Device Single Audit Program (MDSAP), der Abschluss der FDA-Routineinspektion und die detaillierte Vorbereitung werden zu einer unkomplizierten Prüfung durch die FDA beitragen. Die de novo/510(k)-Anträge werden parallel zu den EUA-Anträgen gestellt.
Wow das sind die guten Nachrichten auf die wir lange warten mussten. Jetzt kanns los gehen! Mit der FDA Zulassung die dann im Januar 2022 erfolgen sollte, kann MedMira voll durchstarten. Die Schulden sind in Eigenkapital umgewandelt, die Bilanz deutlich verbessert und will 2022 voll durchstarten.
Genau solch einen Test der wirklich funktioniert, in 3 Minuten ein sicheres Ergebnis zeigt und auch noch zwischen Covid und Grippe unterscheiden kann brauchen wir. Man könnte damit sich langwierige Testschlangen sparen, Auf Veranstaltungen könnte man das schnell und einfach durchführen und auch an Flughäfen, Krankenhäusern, Fussballstadien etc. wären der Zurtitt sicher und einfach. Enorme Anwendungsfelder für MedMira's Wahnsinnstest. Mal sehen wann das erste große Pharmaunternehmen dasteht und mit einsteigen will bzw. MedMira kaufen will. Denn das ist die logische Konsequenz daraus! MedMira hat nicht nur einen Test entwickelt sondern dies ist eine Technologieplattform mit ganz neuen Möglichkeiten!
Dies ist ein Multi-Millionen Dollar Markt weltweit mit irren Wachstumschancen!!!
Ich bin dabei und mein persönliches Kursziel liegt jenseits der 2 CAD Marke in den nächsten 2 Jahren.
Dies ist keine Anlageberatung und keine Aufforderung zum Kauf oder Verkauf von Aktien. Jeder muss selber wissen was für ein Risiko er eingehen kann und sich zutraut. Jeder ist für sich selber verantwortlich.
Achtung Interessenkonflikt: Ich besitze die im Artikel besprochenen Aktien bzw. sind diese im SRC Mining Special Situations Zertifikat enthalten.
Frohe Weihnachten und einen guten Rutsch in 2022!
Ihr Jochen Staiger
Es gilt der Disclaimer der SRC AG: https://www.resource-capital.ch/de/disclaimer-agb/
Enthaltene Werte: CA58501R1029
Die hier angebotenen Beiträge dienen ausschließlich der Information und stellen keine Kauf- bzw. Verkaufsempfehlungen dar. Sie sind weder explizit noch implizit als Zusicherung einer bestimmten Kursentwicklung der genannten Finanzinstrumente oder als Handlungsaufforderung zu verstehen. Der Erwerb von Wertpapieren birgt Risiken, die zum Totalverlust des eingesetzten Kapitals führen können. Die Informationen ersetzen keine, auf die individuellen Bedürfnisse ausgerichtete, fachkundige Anlageberatung. Eine Haftung oder Garantie für die Aktualität, Richtigkeit, Angemessenheit und Vollständigkeit der zur Verfügung gestellten Informationen sowie für Vermögensschäden wird weder ausdrücklich noch stillschweigend übernommen. ABC New Media hat auf die veröffentlichten Inhalte keinerlei Einfluss und vor Veröffentlichung der Beiträge keine Kenntnis über Inhalt und Gegenstand dieser. Die Veröffentlichung der namentlich gekennzeichneten Beiträge erfolgt eigenverantwortlich durch Autoren wie z.B. Gastkommentatoren, Nachrichtenagenturen, Unternehmen. Infolgedessen können die Inhalte der Beiträge auch nicht von Anlageinteressen von ABC New Media und / oder seinen Mitarbeitern oder Organen bestimmt sein. Die Gastkommentatoren, Nachrichtenagenturen, Unternehmen gehören nicht der Redaktion von ABC New Media an. Ihre Meinungen spiegeln nicht notwendigerweise die Meinungen und Auffassungen von ABC New Media und deren Mitarbeiter wider. (Ausführlicher Disclaimer)
