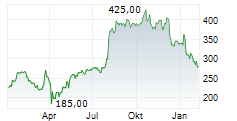
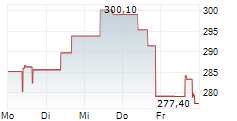
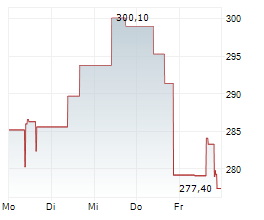
WASHINGTON (dpa-AFX) - Das RNAi-Therapeutika-Unternehmen Alnylam Pharmaceuticals, Inc. (ALNY) gab am Mittwoch die Einreichung seines ergänzenden Zulassungsantrags (sNDA) bei der US-amerikanischen Food and Drug Administration (FDA) für Vutrisiran bekannt, ein in der Entwicklung befindliches RNAi-Therapeutikum zur Behandlung von ATTR-Amyloidose mit Kardiomyopathie (ATTR-CM).
Vutrisiran ist der generische Name für AMVUTTRA, das derzeit von der US-amerikanischen FDA für die Behandlung der Polyneuropathie der hereditären ATTR-Amyloidose bei Erwachsenen zugelassen ist.
Im Rahmen der Einreichung verwendete das Unternehmen einen Priority Review Voucher, der die FDA zu einem beschleunigten Überprüfungszeitplan verpflichtet.
Der sNDA-Antrag bei der FDA basierte auf positiven Ergebnissen von HELIOS-B, einer randomisierten, doppelblinden, placebokontrollierten multizentrischen Phase-3-Studie bei Patienten mit ATTR-CM mit einem umfangreichen Hintergrundeinsatz anderer wirksamer Therapien.
Die Studie zeigte günstige Auswirkungen von Vutrisiran auf den Tod und kardiovaskuläre Ereignisse, die Funktionsfähigkeit und die Lebensqualität bei Patienten mit ATTR-CM.
Das Sicherheitsprofil von Vutrisiran in HELIOS-B stimmte mit dem etablierten Profil des Medikaments überein. In der Studie HELIOS-B waren die Raten von unerwünschten Ereignissen, schwerwiegenden unerwünschten Ereignissen, schweren unerwünschten Ereignissen und unerwünschten Ereignissen, die zum Absetzen des Studienmedikaments führten, im vutrisiranischen und im Placebo-Arm ähnlich.
Urheberrecht(c) 2024 RTTNews.com. Alle Rechte vorbehalten
Copyright RTT News/dpa-AFX
© 2024 AFX News