Anzeige / Werbung
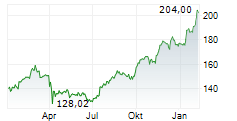
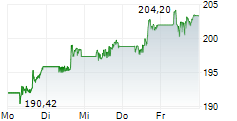
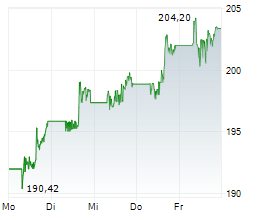
Während Tech-Aktien zuletzt schwächelten, vollzieht der Pharma-Riese eine beeindruckende Rallye - doch ist der steile Anstieg bereits zu weit gelaufen? Der Gesundheitskonzern Johnson & Johnson (US4781601046) präsentiert sich im aktuellen Chartbild in hervorragender technischer Verfassung. Mit einem gestrigen Schlusskurs von 165,12 USD notiert die Aktie nahe am Tageshoch von 166,46 USD und hat damit ...Den vollständigen Artikel lesen ...© 2025 TokenPress