DJ Bayer beantragt EU-Zulassung für Finerenon bei Herzinsuffizienz
DOW JONES--Bayer hat für sein Nierenmedikament Finerenon bei der Europäischen Arzneimittel-Agentur (EMA) eine EU-Zulassung für die Behandlung von erwachsenen Patienten mit Herzinsuffizienz beantragt. Basis ist das positive Ergebnis der zulassungsrelevanten Phase-3-Studie vom vergangenen Sommer, wie der Pharma- und Agrarchemiekonzern mitteilte. Es gehe um die Behandlung von Herzpatienten mit einer linksventrikulären Auswurfleistung von mindestens 40 Prozent. Diese Patientengruppe mache die Hälfte aller Herzinsuffizienz-Fälle aus, erklärte Bayer. Hier stünden derzeit nur begrenzte zugelassene und leitliniengerechte Behandlungen zur Verfügung.
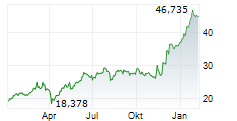
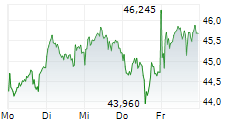
Unter dem Markennamen Kerendia wird Finerenon in mehr als 90 Ländern zur Behandlung erwachsener Patienten mit chronischer Nierenerkrankung in Verbindung mit Typ-2-Diabetes eingesetzt. Das Medikament gilt als möglicher Blockbuster.
Kontakt zum Autor: olaf.ridder@wsj.com
DJG/rio/mgo
(END) Dow Jones Newswires
February 03, 2025 03:28 ET (08:28 GMT)
Copyright (c) 2025 Dow Jones & Company, Inc.